Wibroterapia o częstotliwości 20 Hz indukuje stres komórkowy i apoptozę w komórkach nowotworowych A431
Wprowadzenie: mechaniczne podejście do terapii nowotworów
Tradycyjne metody leczenia nowotworów, takie jak chemio- czy radioterapia, opierają się na środkach chemicznych lub promieniowaniu, które niestety często uszkadzają także zdrowe tkanki. Mechanomedycyna stanowi alternatywne podejście, wykorzystując bodźce fizyczne (mechaniczne) do wpływania na komórki. Niskoczęstotliwościowe wibracje mechaniczne były już wcześniej badane pod kątem wpływu na komórki – zdrowe komórki (np. kostne) reagują na nie korzystnie (wzrostem i aktywacją genów regeneracyjnych), natomiast komórki nowotworowe mogą wykazywać reakcje negatywne. W szczególności we wcześniejszych pracach wykazano, że wibracje 20 Hz potrafią indukować apoptozę (zaprogramowaną śmierć) w komórkach ludzkiego nabłonkowego raka skóry A431. Nowe badanie opublikowane w FEBS Open Bio (2025) pogłębia tę wiedzę, profilując efekty takich wibracji na metabolizm i stres oksydacyjny komórek rakowych przed ich śmiercią.
Metoda: godzinna stymulacja 20 Hz o niskiej amplitudzie
Badacze zastosowali godzinną stymulację mechaniczną o częstotliwości 20 Hz na kulturach komórkowych linii A431 (ludzkie komórki raka płaskonabłonkowego skóry). Wibracje miały amplitudę ok. 140 µm (0,14 mm) i przyspieszenie około 0,23 g. Warunki hodowli przed stymulacją zostały dodatkowo zaostrzone – komórki przez 24 godziny inkubowano w pożywce o obniżonej zawartości glukozy (1 g/L) i bez surowicy, aby zwiększyć ich wrażliwość na stres metaboliczny. Równolegle prowadzono kontrolne hodowle bez wibracji. Co istotne, oprócz komórek nowotworowych A431, eksperyment objął również dwie linie zdrowych komórek: C2C12 (mysie komórki mięśniowe) oraz L929 (mysie fibroblasty). Umożliwiło to porównanie, czy mechaniczna stymulacja działa selektywnie na komórki nowotworowe, czy też wpływa na zdrowe komórki.
Spowolnienie metabolizmu glukozy i wzrost stresu oksydacyjnego
Wyniki wykazały wyraźne oznaki stresu metabolicznego w komórkach A431 poddanych wibracjom. Stwierdzono, że tempo zużycia glukozy przez komórki rakowe uległo obniżeniu w porównaniu z próbkami kontrolnymi. Już wkrótce po stymulacji mechanicznej zaobserwowano, że w medium hodowlanym pozostaje więcej glukozy niż normalnie – szczególnie istotna różnica pojawiła się około 8 godzin po zabiegu. To wskazuje, że komórki A431 pod wpływem wibracji konsumowały cukier wolniej, prawdopodobnie z powodu zaburzeń w metabolizmie spowodowanych stresem. Co ciekawe, we wcześniejszym badaniu tego samego zespołu spadek pobierania glukozy następował dopiero po 24–48 godzinach od wibracji. Przyspieszenie efektu w obecnej pracy tłumaczone jest bardziej stresującymi warunkami (niższa dostępność glukozy i aminokwasów przed stymulacją), co mogło spotęgować podatność komórek rakowych na bodziec mechaniczny.
Równolegle wzrosły oznaki stresu oksydacyjnego w komórkach nowotworowych. Zaraz po zakończeniu 1-godzinnej wibracji (oznaczany jako czas 0 h) w komórkach A431 zaobserwowano gwałtowny skok poziomu ROS (reaktywnych form tlenu) -był on istotnie wyższy niż w komórkach kontrolnych niepoddanych drganiom. ROS to cząsteczki sygnalizacyjne, które w nadmiarze działają toksycznie i mogą inicjować śmierć komórki poprzez uszkodzenia m.in. mitochondrialne. Nagromadzenie ROS tuż po wibracji sugeruje, że komórki zostały wprawione w silny stan stresu oksydacyjnego, który mógł zapoczątkować kaskadę prowadzącą do ich późniejszej śmierci. W literaturze wysoki poziom ROS w komórkach rakowych często towarzyszy uruchomieniu apoptozy, co zbieżne jest z obserwacjami w tym eksperymencie.
Aktywacja genów stresu komórkowego (HSP70, HMGB1)
Analiza ekspresji genów potwierdziła, że wibracje wywołały w komórkach A431 silną odpowiedź stresową na poziomie molekularnym. Tuż po zakończeniu stymulacji (0 h) odnotowano istotny wzrost miana mRNA dwóch genów związanych ze stresem komórkowym: HSPA1A i HMGB1. Gen HSPA1A koduje białko HSP70 (Heat Shock Protein 70), pełniące rolę ochronną w komórce – pomaga w prawidłowym fałdowaniu białek i chroni komórkę przed uszkodzeniami w warunkach stresu (np. wysokiej temperatury czy toksyn). Z kolei HMGB1 (High Mobility Group Box 1) to białko uwalniane przez uszkodzone lub umierające komórki, pełniące funkcję sygnału alarmowego (DAMP) informującego układ odpornościowy o zagrożeniu. Podwyższona ekspresja obu genów bezpośrednio po wibracji świadczy o tym, że komórki A431 zostały poważnie „zdenerwowane” bodźcem mechanicznym. Co ważne, po 24 godzinach od stymulacji poziomy mRNA HSPA1A i HMGB1 w komórkach wibrowanych spadły poniżej poziomów kontrolnych. Taka początkowa nadekspresja, a następnie załamanie ekspresji genów stresu jest zgodna z scenariuszem, w którym komórki najpierw mobilizują mechanizmy obronne, ale ostatecznie ulegają procesowi śmierci (w wyniku czego aktywność tych genów zanika, gdy komórki giną).
Apoptoza komórek nowotworowych po 24 godzinach
Kluczowym rezultatem badania jest obserwacja zwiększonej śmierci komórek rakowych A431 w ciągu 24 godzin od zastosowania wibracji, podczas gdy komórki niepoddane stymulacji pozostawały w większości żywe. Analiza przeżywalności wykazała, że odsetek martwych komórek A431 rósł istotnie w ciągu doby po drganiach, co sugeruje wyzwolenie procesów prowadzących do śmierci komórki. Zaobserwowano też zmiany morfologii komórek charakterystyczne dla apoptozy – komórki A431 po wibracji stawały się zaokrąglone, kurczyły się i tworzyły mniejsze skupiska. Takie zmiany kształtu wynikają prawdopodobnie z przebudowy cytoszkieletu pod wpływem bodźca mechanicznego i są typowe dla komórek wchodzących na szlak zaprogramowanej śmierci (zanik połączeń z podłożem, obkurczenie komórki i blebbing – tworzenie pęcherzyków na powierzchni). Wszystkie te przesłanki wskazują, że 20 Hz wibracja zainicjowała w komórkach A431 proces apoptozy, zgodnie z wcześniejszymi hipotezami autorów.
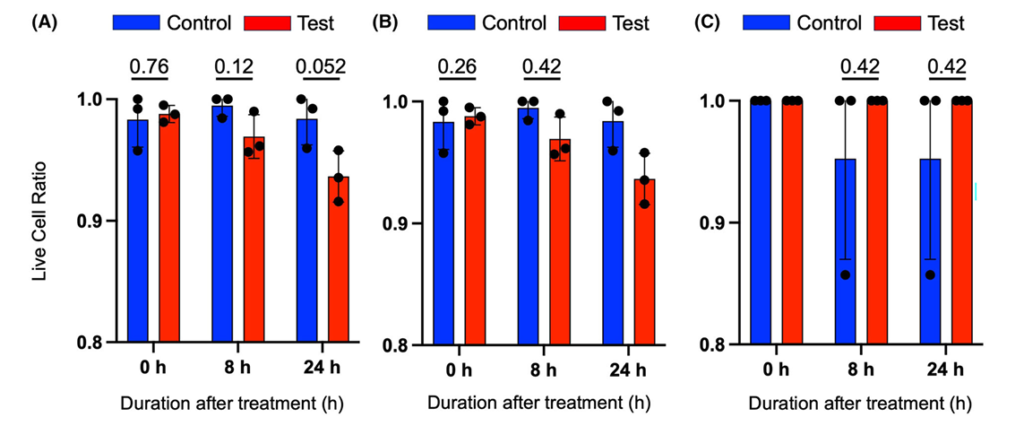
Stymulacja mechaniczna zwiększa odsetek obumierających komórek A431. Liczby podane nad każdym punktem czasowym to wartości P. Każdą wartość P obliczono za pomocą testu t Welcha. Po 24 godzinach wartość P wynosiła 0,052. Odsetek martwych i żywych komórek obliczono dla linii komórkowych: (A) A431, (B) C2C12 oraz (C) L929. Dane przedstawiono jako średnią ± SD dla n = 3.
[Żródło: FEBS Open Bio . 2025 Aug;15(8):1365-1375.]
Warto podkreślić, że efekt ten był specyficzny dla komórek nowotworowych. Zdrowe linie komórkowe C2C12 i L929 nie wykazały istotnego wzrostu śmierci komórkowej po wibracji – w okresie 24 godzin od stymulacji ich przeżywalność pozostała na poziomie zbliżonym do próbek kontrolnych. Również nie obserwowano u nich opisanych wyżej reakcji stresowych (brak skoku ROS czy aktywacji genów HSP70/HMGB1). 20-hercowe wibracje, które tak silnie uderzają w komórki rakowe, okazały się niegroźne dla prawidłowych komórek – co jest istotnym wnioskiem z punktu widzenia potencjalnej terapii.
Wnioski i perspektywy
Badanie dostarcza dowodów, że mechaniczna stymulacja o niskiej częstotliwości (20 Hz) i niewielkiej amplitudzie może selektywnie indukować śmierć komórek nowotworowych poprzez wywołanie stresu metabolicznego i oksydacyjnego. Godzinne wibracje spowalniają metabolizm glukozy i zwiększają produkcję ROS w komórkach raka A431, prowadząc do uruchomienia szlaku apoptozy. Towarzyszy temu przejściowa aktywacja genów stresu (HSP70, HMGB1) świadcząca o reakcji obronnej komórek, która jednak okazuje się niewystarczająca – po 24 godzinach większość pobudzonych mechanicznie komórek nowotworowych ulega śmierci. Efekt wibracji jest wybiórczy, gdyż nie zaobserwowano podobnych negatywnych następstw w zdrowych komórkach (C2C12, L929) poddanych identycznemu bodźcowi. To sugeruje, że 20 Hz mechaniczne drgania uruchamiają specyficzne ścieżki stresu i śmierci obecne w komórkach nowotworowych, a nieaktywne w prawidłowych – co czyni z nich obiecujące narzędzie do celowanej walki z rakiem.
Wnioski te wzmacniają koncepcję mechanicznej terapii nowotworów. Skoro sam fizyczny bodziec może doprowadzić do eliminacji komórek nowotworowych, potencjalnie można by ograniczyć stosowanie agresywnych metod chemicznych czy radiologicznych. Oczywiście, droga do klinicznego zastosowania jest jeszcze daleka – dotychczasowe rezultaty uzyskano in vitro na liniach komórkowych. Kolejnym krokiem będą prawdopodobnie badania na modelach zwierzęcych, aby potwierdzić, że wibracje mogą hamować wzrost guzów w organizmach żywych, nie czyniąc szkody zdrowym tkankom. Niemniej jednak, już teraz badanie potwierdza skuteczność mechanicznego „uderzenia” w komórki rakowe i stanowi dowód na istnienie nowego, niekonwencjonalnego szlaku terapeutycznego. Biomechaniczne leczenie raka – brzmi nietypowo, ale wraz z kolejnymi odkryciami może stać się realną alternatywą lub uzupełnieniem dla tradycyjnych metod onkologii, oferując bardziej selektywne i przyjazne dla pacjenta podejście.
Na podstawie:


